温州医科大学研究者们揭示了靶向PDE4DIP是一种有前景的KRAS突变结直肠癌的治疗策略
结直肠癌(CRC)是世界上第三大常见癌症,每年约有200万新诊断的结直肠癌患者。结直肠癌的发生是一个多步骤的过程,其结果是结肠粘膜细胞中基因突变和表观遗传修饰的积累,最终导致结直肠癌的发生和恶性进展。
KRAS是结肠癌患者中最常见的突变癌基因,目前还没有临床证明的治疗KRAS驱动的结直肠癌的策略。因此,更全面地了解这一关键基因的调控机制,将有助于临床治疗结直肠癌。

图片来源:https://doi.org/10.1038/s41419-023-05885-y
近日,来自温州医科大学的研究者们在Cell Death and Disease杂志上发表了题为“PDE4DIP contributes to colorectal cancer growth and chemoresistance through modulation of the NF1/RAS signaling axis”的文章,该研究工作揭示了PDE4DIP与NF1/RAS信号转导之间的一种新的功能联系,并提示靶向PDE4DIP是一种有前景的KRAS突变结直肠癌的治疗策略。
磷酸二酯酶4D相互作用蛋白(PDE4DIP)是一种与环核苷酸磷酸二酯酶相关的中心体/高尔基体蛋白。PDE4DIP在人类癌症中常见突变,其在小鼠身上的变化导致患肠癌的易感性。然而,PDE4DIP在人类癌症中的生物学功能仍不清楚。
在本研究中,研究者首次报道了PDE4DIP在结直肠癌(CRC)生长和适应性MEK抑制剂(Meki)耐药中的致癌作用。我们发现PDE4DIP在结直肠癌组织中表达上调,并与结直肠癌患者的临床特征和预后不良有关。PDE4DIP的敲除通过抑制核心RAS信号通路而损害KRAS突变的CRC细胞的生长。
PDE4DIP通过抑制Ras GTP酶激活蛋白(RasGAP)、神经纤维蛋白(NF1)的表达,在RAS/ERK信号通路的全面激活中发挥重要作用。在机制上,PDE4DIP促进PLCγ/PKCε重新聚集到高尔基体,导致PKCε的结构性激活,从而触发NF1的降解。通过重新激活RAS/ERK通路,PDE4DIP上调导致KRAS突变的结直肠癌产生适应性Meki耐药。
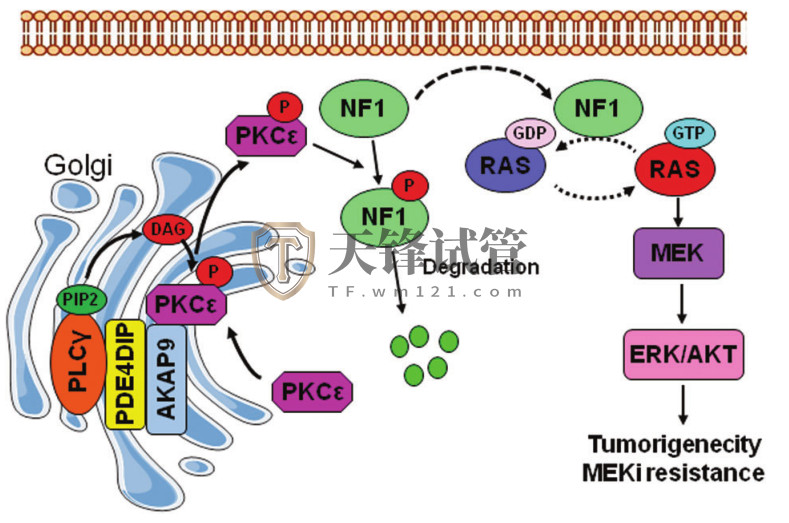
PDE4DIP在CRC细胞中介导RAS信号激活的机制示意图
图片来源:https://doi.org/10.1038/s41419-023-05885-y
综上所述,研究者报道PDE4DIP通过调节核心RAS信号通路在结直肠癌的发生和Meki耐药中发挥致癌作用。本研究揭示了一个新的PDE4DIP介导的PKCε/NF1/RAS信号转导轴,并强调PDE4DIP是一个有希望的KRAS突变癌症的治疗靶点。(生物谷 Bioon.com)





